Виробництво і застосування сульфатної кислоти
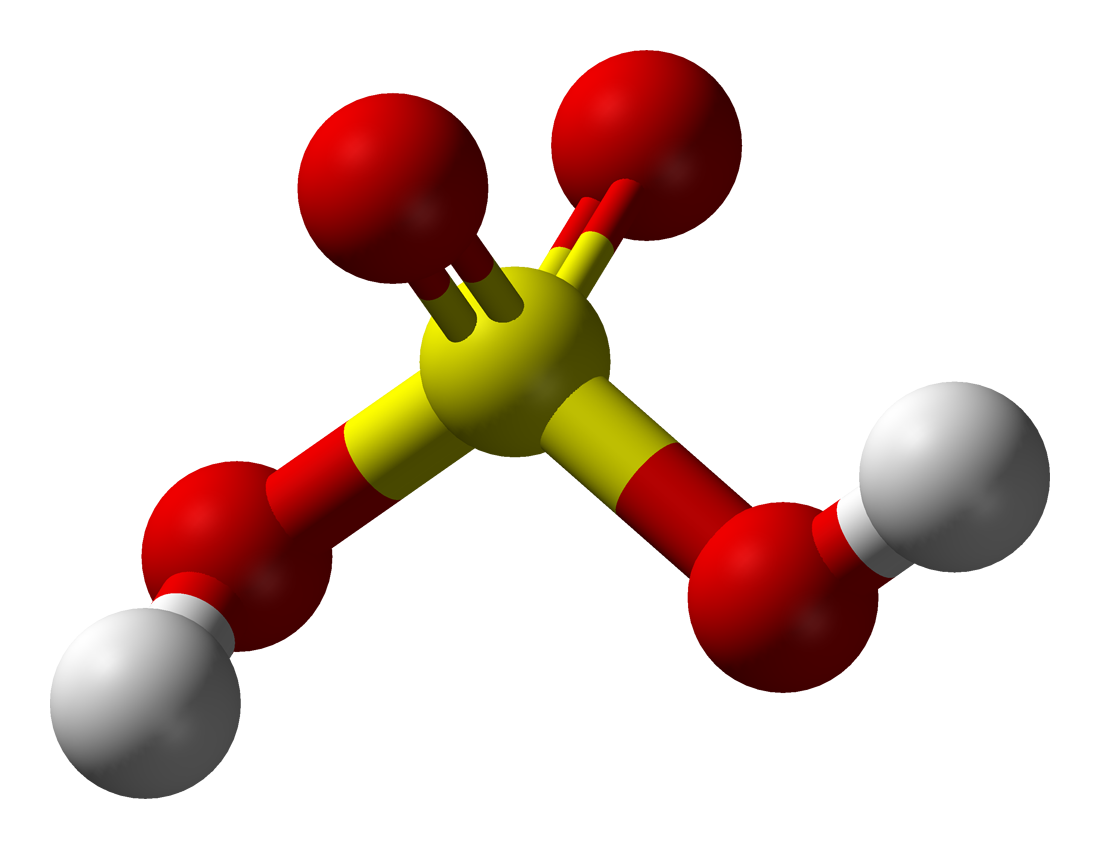
Сульфатна кислота (сірчана кислота, купоросне масло) – це сірчана сполука, сильна двоосновна кислота з найбільшим ступенем окислення сірки. У звичайних умовах концентрованій рідкій речовині характерні важкий маслянистий стан, гігроскопічність, відсутність колірно-ароматичних параметрів, кислий «мідний» смак і слабка струмопровідність через незначну дисоціацію. Також найменування «сульфатна кислота» може стосуватися її сумішей з водою і сірчаним газом. Молярна маса – 98,078 г /моль, густина – 1,8356 г/см³. Формула: H2SO4.
Ця речовина добре розчиняється у воді, змішуючись з нею в будь-яких пропорціях. У процесі цього відбувається виділення тепла і сильне нагрівання розчину, аж до закипання. З огляду на це, при змішуванні кислоти з водою, остання трансформується в пару, що призводить до розбризкування кислоти. Щоб запобігти втратам, кислоту потрібно вливати в воду тонкою цівкою, а не навпаки. І не забувайте помішувати розчин за допомогою скляної палички.
Виробництво сірчаної кислоти
Виробництво сірчаної кислоти як надважливого технічного матеріалу посідає лідерські позиції в світі – понад 150 млн тонн на рік. Існують різні способи її отримання, серед яких:
- промисловий, або контактний, що полягає в окисленні сірчистого газу до сірчаного ангідриду, з подальшим його поєднанням з водою. Концентрація кислоти на виході становить 92-94 %. Її, аналогічно до назви способу, називають контактною;
- нітрозний, або баштовий, суть якого полягає в окисленні сірчистого ангідриду за допомогою NO2 в присутності води. Цей спосіб раніше був більш популярний, ніж зараз. Концентрація речовини виходила 75 %, а іменували її баштовою сірчаною кислотою.
Крім того, ця сполука може виступати побічним продуктом при витісненні сульфату зі солі сірководнем, синтезуватися з елементарної сірки, сірковмісних руд (сульфідів і сульфатів металів), сірководню, газових відходів теплових електростанцій, піриту тощо.
Основні стадії синтезу виглядають так:
- спалювання/випал сировинних матеріалів у кисні з виходом SO2;
- очищення від газових домішок;
- окислення двооксиду сірки в триоксид;
- абсорбція триоксиду сірки водою.
Обов’язково при цьому дотримуються головних наукових принципів хімічного виробництва: безперервність, протиструм, каталіз, максимізація ділянки контакту речовин, що вступають у реакцію, теплообмін, раціональне залучення сировини.
Застосування
Сульфатну кислоту використовують у різних галузях.
Переважна її кількість йде на виготовлення мінеральних добрив (суперфосфату, сульфату амонію та ін.). Не рідкість – сусідство заводів, що спеціалізуються на випуску кислоти, з заводами із виготовлення сільськогосподарських добрив.
Також чимало цієї речовини йде на потреби хімічної промисловості. Тут вона виступає каталізатором органічного синтезу, бере участь у створенні інших кислот неорганічної природи і мінеральних солей, мийних засобів, штучних смол, фарбувальних матеріалів та антифризів. Її задіюють при виготовленні фармацевтичних та ветеринарних препаратів, інсектицидів і в різних технічних процесах.
Певна кількість цієї сполуки витрачається на фарби, зокрема і друкарські, а також емалі й пігменти. Ця кислота може служити осушувачем газів, сприяти видобутку рідкісних металів (цирконію, осмію, урану, іридію) з руд, задіюватися у виробництві утворювачів диму і вибухівки.
У харчопромі вона зареєстрована як добавка до їжі-емульгатор E513.
Більше інформації про сульфатну кислоту – за контактними номерами. Звертайтеся!



